TargetMol中国品牌商
12 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
FDA 认定!KRAS 靶点将摆脱“不可成药”困境
1944 人阅读发布时间:2021-09-09 09:19
PART 1 KRAS 是什么
KRAS (Kirsten-RAS) 基因属于 RAS 基因家族。RAS 基因家族当中,还有 NRAS (neuroblastoma-RAS) 和 HRAS (Harvey-RAS)。RAS 是癌症中最常见的突变基因家族,其中 KRAS 突变最常见,约占 85%,其是已知的三种最致命的癌症——肺癌、结直肠癌和胰腺癌的重要驱动因素。
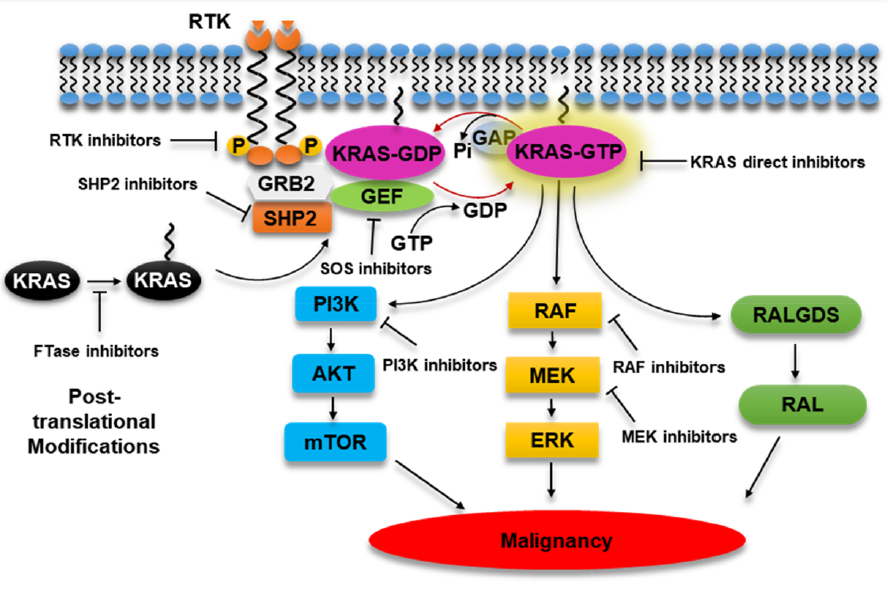
KRAS 蛋白是由 KRAS 基因编码的一种小 GTP 酶 (small GTPase),是细胞生存和生长的重要调节蛋白。它是一个调节细胞生存和生长的「总开关」,在结合 GTP(鸟苷三磷酸)时是激活状态,可以激活一系列的下游通路,而结合的 GTP 被水解成 GDP(鸟苷二磷酸)后,RAS 变回失活状态。正常情况下,KRAS 活化后,会马上失活。致癌突变的 RAS 蛋白,包括 KRAS G12C 蛋白,都表现出 GTP 酶活性的受损,使其更倾向于停留在 GTP 结合状态,导致 RAS 蛋白持续激活,进而不断激活下游靶点如 RAF、MEK 及 ERK 等,使得细胞不断增殖、分化、形成肿瘤。
PART 2 药物开发难点
虽然 KRAS 的致癌原理早已阐明,但在之前的30多年开发相关的靶向药物却困难重重。
首先,KRAS 作为 GTP 酶,与 GTP 的结合亲和力高达皮摩尔级别。而正常细胞里面的 GDP 与 GTP 的浓度,达到了微摩尔级别。相对一般激酶的纳摩尔级别结合亲和力,KRAS 与底物皮摩尔级别的结合亲和力是非常高的。
另外,因为 KRAS 蛋白结构平滑、近乎球形,无明显结合位点,很难合成一种能靶向结合并抑制其活性的化合物。长期以来无法攻克,KRAS 已成为肿瘤药研发领域「不可成药」靶点的代名词。在化学药开发方向,由于 KRAS 蛋白结构特点,其表面结合小分子的疏水性口袋并不明显;在生物药开发方向,抗体药穿透细胞膜靶向 RAS 蛋白,药物递送效率也有很大的提升空间。
PART 3 可能的药物开发策略
1 直接靶向 KRAS
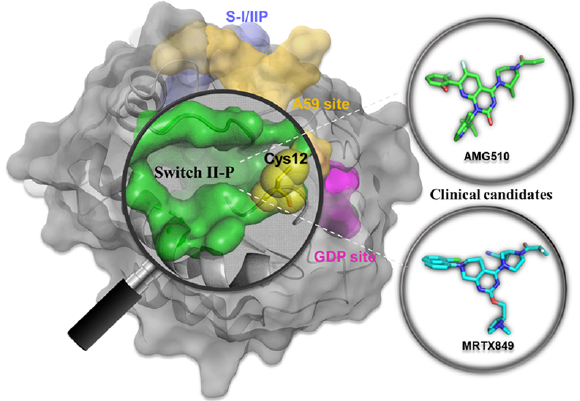
在研究化合物与 KRAS G12C 突变体结合的复合体时,发现了 KRAS G12C 突变体蛋白上面存在着一个选择性共价结合 Cys12 的潜在小分子结合口袋。小分子化合物与这个口袋结合后能够将 KRAS G12C 突变体「锁死」在失活的构象,从而为抑制 KRAS 突变体的活性提供了潜在的靶标。MRTX849 和 AMG510 均靶向这一结合口袋,通过跟失活状态的 KRAS G12C 突变蛋白结合,把异常激活的 KRAS G12C 蛋白强行拉回失活状态。
2 调节 RAS 与质膜结合的蛋白酶
RAS 蛋白需要定位在细胞质膜内表面上才能发挥作用,因此,抑制 KRAS 的膜定位,可以抑制 KRAS 突变引起的持续激活。在膜定位过程中,FTase(法尼基转移酶)起了关键作用。FTase 抑制剂 (FTIs) 的作用机制为抑制 FTase(法尼基转移酶),从而阻止 Ras 蛋白转化成活化状态。然而,在存在 FTIs 的情况下,KRAS 也可以选择通过 1 型香叶基香叶基转移酶进行膜定位,从而克服 FTIs 的抑制作用。因此,针对 FTase 的抑制剂临床实验并不尽如人意。
3 靶向 KRAS 下游靶点
由于设计直接靶向 KRAS 的抑制剂难度较大,许多科学家选择设计针对 KRAS 下游的信号通路的靶向药物。实际上,靶向 RAS 下游效应信号传导阻断下游效应子信号传导是靶向 RAS 最具吸引力的策略之一。例如,设计针对 RAF-MEK-ERK 或 PI3K/AKT/mTOR 的靶向药物。值得注意的是,sorafenib,一种多激酶抑制剂,对 RAF 激酶家族具有适度活性,在临床前和临床二期阶段表现出良好潜力,然而临床三期客观缓解率 (ORRs) 一般不到 10%,中位数 PFS≈3 个月。单一的 MEK 变构抑制剂临床结果同样令人失望,selumetinib 或 trametinib 均未表现疗效。其他下游抑制剂,如 mTOR 抑制剂 ridaforolimus 表现出 PFS 的一定增长,但是面临着一些副作用。总之,研究 KRAS 下游抑制剂的临床试验,大部分疗效有限而伴随一定毒性。
4 间接靶向 KRAS
绕过 KRAS 蛋白缺乏小分子药物结合靶点的另一个方法是通过创新治疗模式间接靶向 KRAS 蛋白。在这方面,靶向蛋白降解剂,RNAi 疗法,反义寡核苷酸疗法和癌症疫苗都是研究人员探索的方向。
综上,虽然 KRAS 是「臭名昭著」的「不可成药」靶点,科学家依然坚持不懈地在开发多种疗法去应对 KRAS 突变引发的疾病。特别是 AMG510 的上市,给 KRAS 突变的肿瘤患者带来了福音,相信在不久的将来将会有更多 KRAS 突变的靶向药物上市,给患者带去更多新的希望。
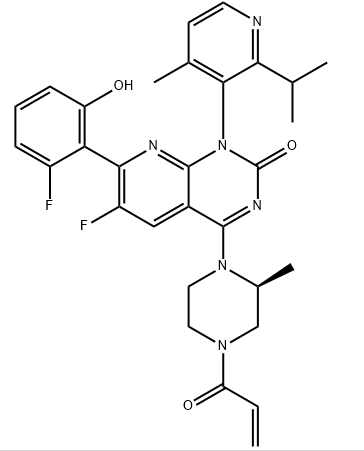
Fig 4. AMG510 结构
相关产品
AMG-510
AMG-510 is a selective and orally bioavailable KRAS G12C covalent inhibitor.
MRTX849
MRTX849 is a potent, selective and covalent KRASG12C inhibitor with potential antineoplastic activity. It selectively modifies mutant cysteine 12 in GDP-bound KRASG12C, and inhibits KRAS-dependent signaling.
KRAS inhibitor-9
KRAS inhibitor-9 is a potent KRAS inhibitor with Kd of 92 μM that blocks the formation of GTP-KRAS and downstream activation of KRAS. KRAS inhibitor-9 causes G2/M cell cycle arrest and induces apoptosis. KRAS inhibitor-9 selectively inhibits the proliferation of NSCLC cells with KRAS mutation but not normal lung cells.
MRTX-1257
MRTX-1257 is a selective, irreversible and covalent inhibitor of KRAS G12C. It has an IC50 of 900 pM for KRAS dependent ERK phosphorylation in H358 cells. MRTX1257 demonstrated 31% bioavailability in the mouse, with free fraction exposures well above the cellular potency In a PK/PD experiment, 77% target engagement.
抗癌化合物库
4,596 种肿瘤相关的生物活性小分子化合物的特有集合,靶点含 PI3K、HDAC、mTOR、CDK、Aurora Kinase、JAK 等,是肿瘤发生机理研究、抗肿瘤药物筛选的有效工具。
抗癌上市药物库
397 个具有抗癌活性小分子的独特集合,所有化合物都经过了严格的临床前研究和临床试验,由 FDA、EMA 或 CFDA 批准上市,可用于高通量、高内涵筛选。
抗癌天然产物库
1,059 种来源于植物、动物或微生物的具有已知或潜在抗肿瘤活性天然产物,性价比高,能够为您提供肿瘤药物开发、天然先导化合物筛选等研究的有力工具。
除以上产品,陶素生化还可以提供多种抗癌相关的化合物和化合物库,感兴趣的客户可通过下方联系方式随时联系我们,也可登录 www.tsbiochem.com 官网查看产品和服务的更多信息。
参考文献
[1] FDA Approves First KRAS Inhibitor: Sotorasib. Cancer Discov. 2021 Jun 22. doi: 10.1158/2159-8290.CD-NB2021-0362. Epub ahead of print. PMID: 34158284.
[2] Uprety D, Adjei A A. KRAS: From undruggable to a druggable Cancer Target[J]. Cancer Treatment Reviews, 2020, 89:102070.
[3] Ghimessy A, Radeczky P, Laszlo V, et al. Current therapy of KRAS-mutant lung cancer[J]. Cancer and metastasis reviews, 2020(7689).
[4] Chen H, Smaill J B, Liu T, et al. Small-Molecule Inhibitors Directly Targeting KRAS as Anticancer Therapeutics[J]. Journal of Medicinal Chemistry, 2020, 63(23):14404-14424.
[5] Lanman B A, Allen J R, Allen J G, et al. Discovery of a covalent inhibitor of KRASG12C (AMG 510) for the treatment of solid tumors[J]. Journal of Medicinal Chemistry, 2019.



