TargetMol中国品牌商
12 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
为啥免疫力总比别人差?《Cell》子刊发现与饮食有关
454 人阅读发布时间:2023-03-13 18:33
近期,由德国和比利时的联合研究团队发表于 Cell Metabolism 的一项研究表明,高盐(HS)饮食会造成免疫细胞新陈代谢受损,甚至能破坏人体免疫系统!

▲点击图片可跳转原文
调节性 T 细胞(regulatory T cell,Treg)是免疫系统重要的“自检”组分,可防止过激的免疫反应。这项研究通过向人 Tregs 和荧光染料 CFSE 标记的 Teff 培养体系中添加 NaCl 模拟高盐饮食后增加的生理性 Na+ 浓度,结合自身免疫性疾病患者分离的 Tregs 进行各种分析,有了以下发现:
高盐暴露导致Treg免疫代谢失调
许多免疫反应是通过细胞代谢的变化来控制的。高盐暴露后会诱导 Treg 基因表达的巨大变化——1,250 个基因上调,1,380 个基因下调,且 Tregs 代谢状态发生改变:
高盐暴露后丙酮酸代谢和三羧酸(TCA)循环下调,尿素循环上调,重要的几种酶也会受到影响。如琥珀酸脱氢酶(SDH),苹果酸脱氢酶,异柠檬酸脱氢酶等。特别是 SDH,SDH 可驱动琥珀酸盐向富马酸盐的酶促转化,在氧化磷酸化(OXPHOS)中发挥关键作用,抑制 SDH 会导致琥珀酸盐积累,减少电子通过线粒体电子传递链(ETC),使得 OXPHS 下调。而琥珀酸的积累和 SDH 的下调也会损害 T 细胞的激活和抗炎因子的产生。
线粒体功能紊乱严重改变Treg功能
研究人员还通过分析高盐和antimycin A(AA) 处理后 Tregs 的变化数据发现:
AA 抑制复合物Ⅲ或高盐暴露后导致维持 Treg 功能稳定的 Foxp3 基因显著下调,IL-10、CTLA-4 上调,IL-2-STAT5 磷酸化通路明显受阻,并且 Treg 的最大呼吸量明显减少,ATP 生产也显著降低,线粒体活性氧增加,膜电位受损。种种数据表明,高盐严重干扰了 Tregs 线粒体的呼吸。
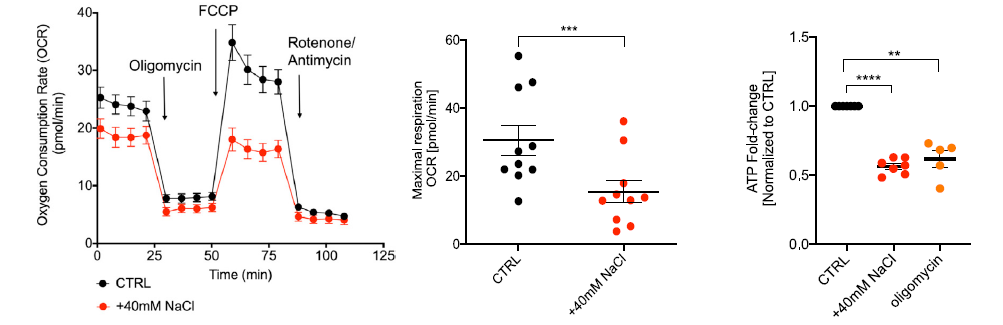
▲不同条件下Tregs的最大好氧率(OCR)和ATP含量
为了进一步确定高盐对体内人 Tregs 功能的影响,研究人员将志愿者分为低盐和高盐组。对 Tregs 分析显示,高盐导致体内 Tregs 中的 IL-10 明显降低,FOXP3 表达减少和 IFN-γ 表达增加。
也就是说,高盐饮食会增加细胞内 Na+ 浓度,并通过干扰电子传递链(ETC)扰乱线粒体呼吸,引起代谢紊乱。这一过程会迅速诱导促炎信号和 FOXP3 下调,导致 Tregs 功能障碍。
同时,小鼠实验也表明,高盐暴露会导致自身免疫性脑脊髓炎(EAE)小鼠的疾病评分显著升高;并且无法阻止异种移植物抗宿主病(xGvHD)小鼠的疾病进展。
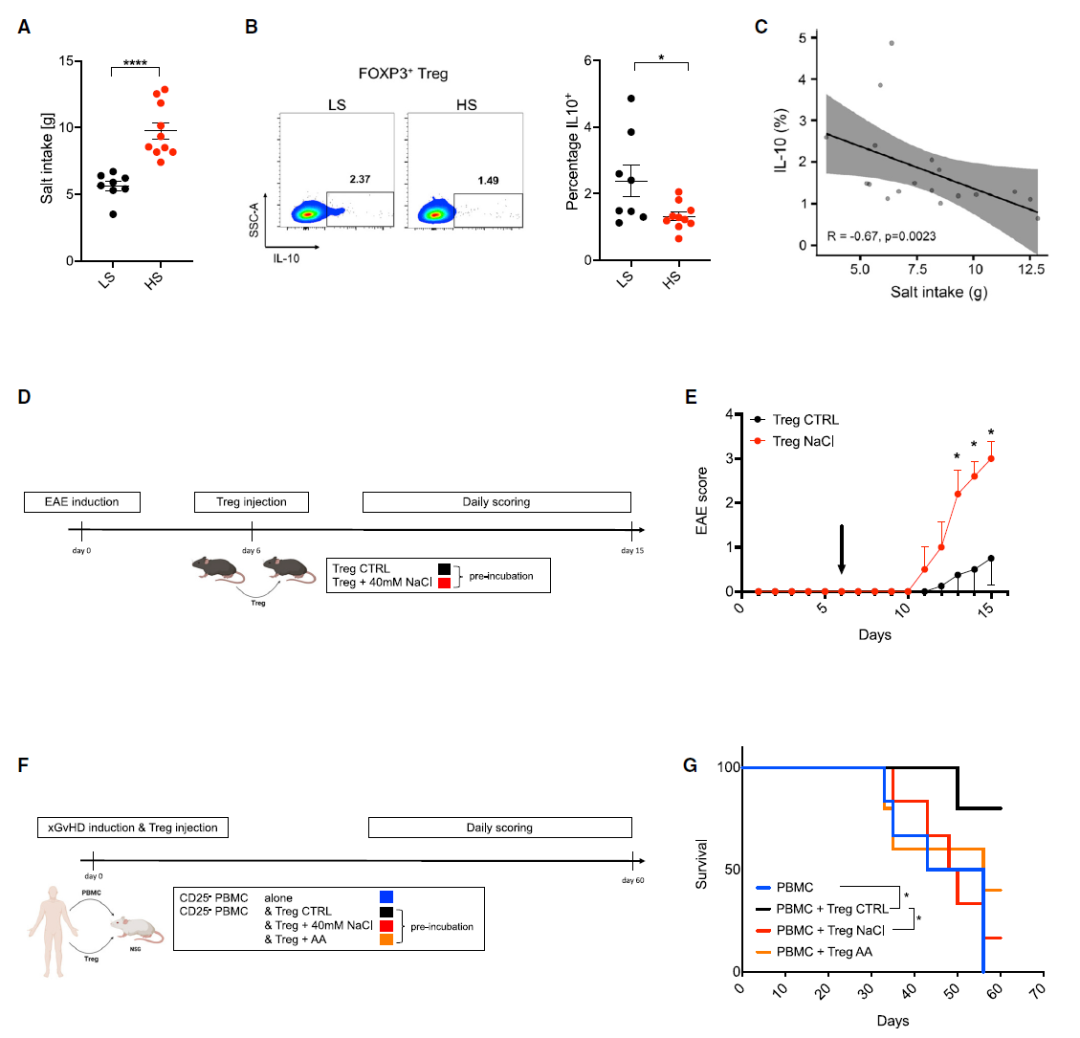
▲HS 对体内 Treg 适应度和功能的影响
总之,这些数据证明了 高盐对线粒体的干扰不止在细胞实验中,在人体和小鼠模型中也会导致 Treg 功能的破坏。
高盐诱导结果可以通过抑制NCLX而逆转
已有的研究表明,在缺氧条件下,Na+ 进入线粒体,受线粒体钠钙交换体(mitochondrial Na+ /Ca2+ exchanger,NCLX)的调节,干扰 OXPHOS 功能[2] [3]。
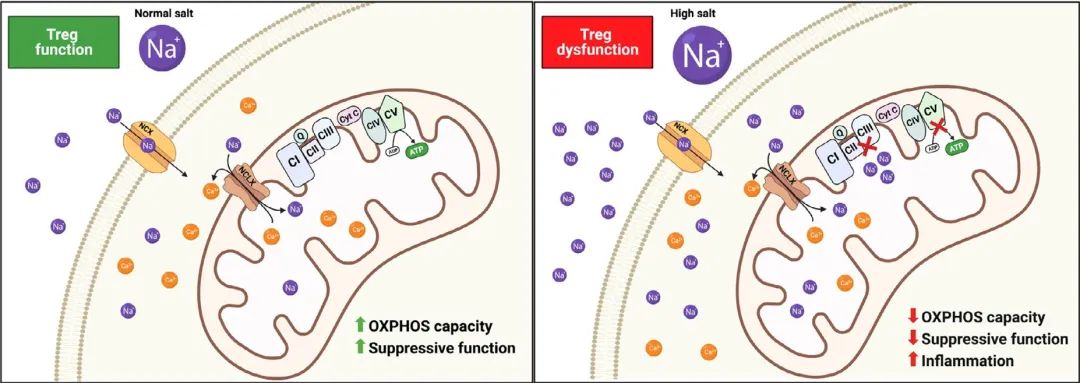
▲NCLX 如何控制 Treg 免疫代谢和功能
考虑到高盐诱导的细胞内 Na+ 的增加和对复合物II/III活性的直接影响,研究人员测试了 NCLX 的特定抑制剂(CGP-37157;CGP)对复合体II/III活性的影响。
结果发现 CGP 可显著逆转盐诱导的复合物II/III活性下降,体现了 Na+ 线粒体内流介导高盐诱导的 ETC 效应。
从机制上讲,Na+ 进入细胞,然后通过 NCLX 被带到线粒体,在线粒体内直接阻断 ETC 复合物II/III水平上的线粒体呼吸,导致 OCR 和线粒体膜电位显著降低,从而降低 ATP 水平。这种基于高盐诱导的线粒体功能障碍是钠如何改变 Treg 功能并导致 FOXP3 快速下调的第一步,这与自身免疫性患者 Treg 十分相似。类似的表型可由药理学阻断或 AA 干扰复合物III诱导。也就是说,HS 诱导的 Treg 功能障碍可通过阻断 NCLX 抑制线粒体 Na+ 内流来逆转。
综上所述,这项研究将膳食盐分的摄入量与免疫功能联系了起来,首次证明了高盐严重影响细胞代谢并会抑制 Tregs 的功能。通过靶向线粒体 NCLX 干扰这一途径可能为改变 Tregs 在不同类型疾病中的功能提供新的策略。
免疫系统的紊乱会导致多种疾病的发生,因此,对免疫系统进行人工干预一方面可以激活免疫防御来对抗容易躲过免疫系统的病原体,另一方面可以抑制由于自体免疫、过敏等所导致的不利免疫反应。陶术现为您推荐 免疫靶向化合物库 助力相关研究,欢迎咨询选购~
参考资料: 1. Beatriz F. Côrte-Real et al, Sodium perturbs mitochondrial respiration and induces dysfunctional Tregs, Cell Metabolism (2023). DOI: 10.1016/j.cmet.2023.01.009 2. Neubert, P., Homann, A., Wendelborn, D., B€ar, A.L., Krampert, L., Trum,M., Schro¨ der, A., Ebner, S., Weichselbaum, A., Schatz, V., et al. (2020).NCX1 represents an ionic Na+ sensing mechanism in macrophages.PLoS Biol. 18, e3000722. https://doi.org/10.1371/journal.pbio.3000722. 3. Neubert, P., Schro¨ der, A., M€uller, D.N., and Jantsch, J. (2019). Interplay of Na(+) balance and immunobiology of dendritic cells. Front. Immunol. 10,599. https://doi.org/10.3389/fimmu.2019.00599.




