TargetMol中国品牌商
12 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
Nature:揭示肿瘤演化过程中TNF的双重作用
547 人阅读发布时间:2024-09-11 11:11
在肿瘤进化过程中,肿瘤始于单个或多个细胞的转化,这些细胞通过随机分布的驱动突变形成克隆扩增,进而积累更多突变实现恶性转化。但仅有少数克隆能转化为恶性肿瘤,其背后的机制尚不清楚。
为了解答这一疑问,苏黎世大学以及苏黎世联邦理工学院的联合研究团队开发了一种CRISPR策略,系统地记录了在胚胎阶段中的克隆扩增情况,并揭示了肿瘤发生与克隆扩增密切的分子过程,相关内容以已In vivo single-cell CRISPR uncovers distinct TNF programmes in tumour evolution为题发表于Nature。

研究人员首先对CROP-seq系统进行了调整,将基因盒中的puromycin替换为mCherry荧光标记,并使用TargetMol的5-ethynyl-2′-deoxyuridine(EdU)作为细胞增殖标记物,通过荧光激活细胞分选(FACS)选择感染的细胞,从而实现对基因干扰的监测和分析。然后通过子宫内病毒微注射、单细胞RNA测序和导向捕获(guide capture)等技术,系统地研究了150个常见的癌基因在克隆扩增和肿瘤发生中的作用。
在进行基因干扰后,对小鼠进行长期观察,并收集样本进行单细胞RNA测序。通过计算每个基因干扰对小鼠的表皮干细胞(EpSCs)的差异基因表达,发现许多驱动克隆扩增的突变与肿瘤坏死因子(TNF)信号通路的基因表达高度相关。
例如,在P60(小鼠出生后60天)细胞群的44个基因模块中,占主导地位的一个主要基因模块就包含了25个与TNF信号相关的基因。
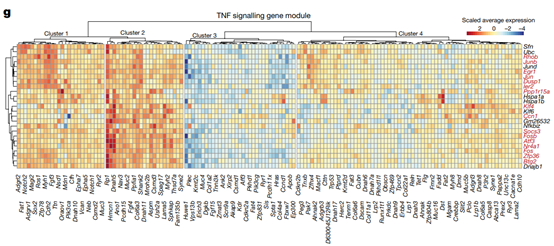
上皮细胞的克隆扩增集中于TNF信号通路
TNF信号主要通过TNF配体与TNF受体1(TNFR1)结合激活,涉及JUN和NF-κB等转录因子。这些转录因子在细胞生长、免疫反应和应激反应等多种生物过程中发挥重要作用。
为了测试TNF通路在上皮克隆扩增中的作用,研究人员使用超声引导的子宫内病毒微注射在胚胎中靶向150个癌基因,随后,比较了在野生型和Tnfrsf1a+/−小鼠P60皮肤中的扩张率。
结果显示,在P60小鼠皮肤中,TNFR1主要在EpSCs和毛囊干细胞中表达,几乎所有的克隆扩增都高度依赖于TNFR1,且高表达TNF基因模块的克隆扩增率较高。
而TNF主要由巨噬细胞分泌,尽管在后天阶段巨噬细胞的去除并未完全阻止克隆扩增,但它们在表皮的克隆扩增中起到了重要的促进作用。这表明巨噬细胞可能是TNF的一个重要来源。
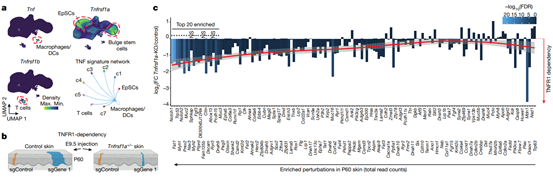
克隆扩增是通过TNF介导的
接下来,研究人员测试了TNF通路在克隆扩增与肿瘤演化中的作用。
通过在小鼠模型中注射靶向150个癌基因的sgRNA库,并在特定时间点(P60)进行化学致癌处理,观察肿瘤的形成和发展。然后使用单细胞RNA测序分析,识别出不同的肿瘤细胞群体,发现在克隆扩增向肿瘤发生的转变过程中,肿瘤细胞会下调用于克隆扩增的TNF模块,并切换到自分泌TNF-MMP9和MMP10轴,促进上皮-间质转化(EMT)的进展,使得肿瘤变得更具侵袭性。并且TNF特征与鳞状细胞癌(squamous cell carcinoma, SCC)患者的较短总体生存期相关。

癌细胞切换到自分泌的TNF基因程序
综上,该研究建立了一个体内单细胞CRISPR平台,系统地解析了常见的150种癌基因在在克隆扩增和肿瘤发生中的作用。发现肿瘤坏死因子(TNF)信号通路是介导克隆扩增的癌症易感性的重要因素。
研究发现部分由巨噬细胞来源的TNF刺激的表皮干细胞(EpSCs)中的TNF信号基因模块,是表型正常皮肤中克隆扩增的通用驱动因素。而在从克隆扩增到肿瘤发生的过渡过程中,这一信号模块被下调,侵袭性癌细胞转向一种与基质重塑因子如MMP9和MMP10相关的自分泌TNF基因程序,以促进与上皮-间质转化相关的侵袭性特性。为开发新的癌症预防和治疗策略提供了基础。

肿瘤进化中不同的TNF程序模型
原文链接:
https://www.nature.com/articles/s41586-024-07663-y



